Retinalproteine
Mikrobielle Rhodopsine besitzen, genauso wie der Sehrezeptor Rhodopsin und die G-Protein gekoppelten Rezeptoren, sieben Helices welche die Membran durchspannen. Rhodopsine besitzen ein Retinal als Chromophor (Chemisch ähnlich zum Vitamin A), welches an ein Lysin über eine protonierte Schiffsche Base (SB) gebunden ist. Die lichtinduzierte Isomerisation des Retinals (meistens vom all-trans zum 13-cis) startet eine zyklische Reaktion: den Photozyklus.
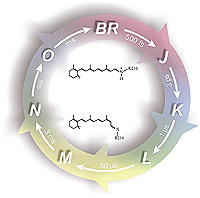
Bacteriorhodopsin. Das zuerst entdeckte und bisher am besten untersuchte mikrobielle Rhodopsin ist die lichtgetriebene Protonenpumpe Bacteriorhodopsin (bR). Nach Anregung mit grünem Licht deprotoniert die SB in weniger als hundert Mikrosekunden. Dies führt zu einer Reihe von weiteren Protonentransferreaktionen die unterm Strich zu einem vektoriellen Protonentransport von der cytoplasmatischen zur extrazellulären Seite führen und in der Wiederherstellung des Grundzustandes enden. Kontrovers diskutiert wird die Gruppe, welche für die Abgabe des Protons auf der extrazellularen Seite zuständig ist. Vieles deutet darauf hin, dass es um ein Netzwerk aus protonierten Wassermolekülen handelt.
Sensorrhodopsin I. Im Gegensatz zu bR ist das Sensorrhodopsin I (sRI) nicht in der Energiegewinnung involviert sondern agiert als Lichtsensor (Phototaxis). Absorbiert sRI oranges Licht führt dies zu einer Isomerisierung des Retinals und zur Bildung des Intermediates S373, in welchem die Schiffsche Base deprotoniert vorliegt. Dieser Prozess führt zu einem anziehenden Signal, so dass sich die Zelle zur Lichtquelle hin bewegt. Im Gegensatz dazu führt die Absorption eines zweiten Photons im nahen UV-Bereich zu einem abstoßenden Signal, so dass sich die Zelle von der Lichtquelle weg bewegt. Die durch das Anregungslicht induzierten Konformationsänderungen werden an Htr I übertragen, einem Membranprotein das mit dem sRI assoziiert ist. Die konkrete Kommunikation zwischen diesen beiden Proteinen ist nur zum Teil bekannt. Dieser Komplex repräsentiert ein Modelsystem welches Aufschluss über die allgemeine Signaltransduktion zwischen Proteinen gibt.
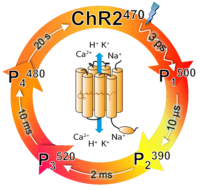
Kanalrhodopsin. Kanalrhodopsine (ChRs) sind die ersten und soweit einzigen lichtgetriebenen Ionenkanäle die in der Natur vorkommen. ChR1 und ChR2 dienen als in der einzelligen Grünalge Chlamydomonas reinhardtii als Rezeptor für Phototaxis. Nach Lichtaktivierung werden sie vorrübergehend durchlässig für Protonen und Kationen (Na+, K+ und Ca2+) was zu einer lichtkontrollierten Depolarisation der Membran führt. In Nervenzellen können somit Aktionspotentiale durch Lichtanregung erzeugt werden, wenn ChR2 in den Membranen expremiert wurde, d.h. Optogenetik. Einzigartig macht die ChRs, dass ihr funktionaler Mechanismus in einem Zeitbereich von Femtosekunden bis Sekunden mit Hilfe kurzer Lichtpulse untersucht werden kann. Der Photozyklus von ChR2 weist vier Intermediate auf, unter anderem den offenen Zustand P3520. Zurzeit wird die Verknüpfung zwischen dem Photozyklus und der Kationendurchlässigkeit, die lichtinduzierte Protonenpumpaktivität sowie der Photozyklus und die Funktion des ChR1 untersucht.