Priv.-Doz. Dr. Michael Haumann
Biophysik von Metallenzymen
Raum 1.2.23, Tel.: 030 838 56101
14195 Berlin, Germany
Siehe meine Seiten "Teaching" für Informationen zu Lehrveranstaltungen im Wintersemester 2025/26!
To our detailed English pages follow the below navigation or this link 
In der Natur werden Metallatome in einer faszinierenden Vielfalt von biologischen Systemen verwendet. Insbesondere enthalten ca. die Hälfte aller Proteine gebundene Metallionen. Besonders interessant ist, dass Metallenzyme ausserordentlich hohe Raten für die Umsetzung kleiner Moleküle zeigen (H2O, H2, O2, CO, CO2, CH4). Diese Reaktionen sind von herausragender Bedeutung auch für Anwendungen, z.B. in den Bereichen erneuerbare Energien, Medizin und industrielle Katalysatoren.
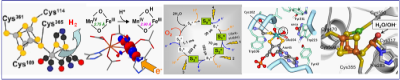
Wir konzentrieren uns auf Grundlagenforschung an biologischen Metallzentren und biomimetischen Modellverbindungen in der Katalyse kleiner Moleküle. Molekulare Strukturen, elektronische Konfigurationen und Kinetiken der Bildiung von Intermediaten werden charakterisiert, um u.a. die Mechanismen der Assemblierung der Kofaktoren und der Substratumsetzung aufzuklären. Generalisierte Einsichten sollen zu einem tieferen Verständnis der Rahmenbedingungen für metallbasierte (Bio)Katalyse führen.

Eine breite Palette von Enzymen und Modellen wird von uns bearbeitet, in Kollaborationen mit weltweiten Forschergruppen. Hydrogenasen bilden H2 an Fe und Ni Zentren und sind vielversprechend für zukünftige Energieanwendungen. Verschiedene Oxidasen besitzen prototypische binukleare Fe oder Mn Bindestellen und sind in O2 Aktivierung und CH4 Umsetzung involviert. Die Bildung des atmosphärischen O2 in der photosynthetischen Wasseroxidation an einem Mn Komplex in Photosystem-II ist der Schlüssel zu solargetriebener Treibstoffgewinnung. Mo Enzyme katalysieren vielfältige essentielle Reaktionen in der Zelle. CO/CO2 Umsetzungen an Ni-Fe Enzymen sind ein neues Thema in dieser Gruppe.

Unsere zentrale Untersuchungsmethode ist Röntgenspektroskopie an Synchrotron-Strahlungsquellen (ANKA, BESSY, DESY, ESRF, MAXLAB, SLS, SOLEIL). Wir setzen Röntgenabsorptions-Spektroskopie (XANES, EXAFS), Röntgenemissions-Spektroskopie (XES), resonante inelastische Röntgenstreuung (RIXS), sowie nukelare resonante Vibrationsspektroskopie (NRVS) ein. Damit werden die Strukturen und elektronischen Eigenschaften von Metallzentren bestimmt, in atomarer Dimension, mit µm räumlicher Auflösung and µs Zeitauflösung. Dichtefunktional-Theorie Rechnungen (DFT) werden gezielt komplementär eingesetzt um Geometrie-optimierte Modellstrukturen und spektrale Simulationen, sowie vertiefte Einsichten in elektronische Eigenschaften zu gewinnen.

