Neue Veröffentlichung in der Fachzeitschrift "Science": Dynamik und Mechanismus einer lichtgetriebenen Chloridpumpe
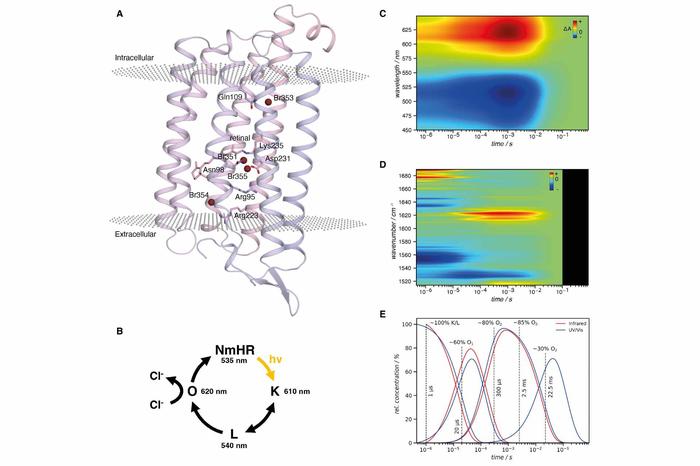
Halogenid-Bindungstellen und Photozyklus des Rhodopsins NmHR sowie Spektroskopiedaten
Bildquelle: Science (3 Feb 2022); DOI: 10.1126/science.abj6663
In Zusammenarbeit mit dem Sonderforschungsbereich 1078 „Proteinfunktion durch Protonierungsdynamik“ hat ein internationales Forschungsteam vorgeschlagen, dass die in einer lichtgetriebenen Chloridpumpe beobachtete Ladungstrennung ein fundametales Merkmal für die Umwandlung von Lichtenergie in Natur und Technik ist.
News vom 14.02.2022
Forscher der Freien Universität Berlin, der ETH Zürich, des Paul-Scherrer-Instituts Villigen und der Hebrew University of Jerusalem haben in einer gemeinsamen Publikation in "Science" den Ionentransferweg in bakteriellem Halorhodopsin beschrieben und das Zusammenspiel zwischen der treibenden Kraft, die durch das Dipolmoment des Proteins erzeugt wird, und der Steuerung des Transports durch molekulare Gates diskutiert. Sie lieferten Details darüber, wie Lichtenergie in kinetische Energie für die Chlorid-Translokation umgewandelt wird. Die daraus resultierende Ladungstrennung stellt ein grundlegendes Merkmal für die Umwandlung von Lichtenergie in Natur und Technik dar.
Der Chloridtransport durch mikrobielle Rhodopsine ist ein grundlegender Prozess. Seine molekularen Mechanismen wie z. B. die Umwandlung von Lichtenergie, welche das Ionenpumpen antreibt und die Unidirektionalität des Transports gewährleistet, waren jedoch bisher nicht ausreichend erforscht. Um den molekularen Mechanismus eines chloridpumpenden Rhodopsins und die strukturelle Dynamik während des Transportzyklus aufzuklären, kombinierte das Forschungsteam zeitaufgelöste serielle Kristallographie mit zeitaufgelöster Spektroskopie und Multiskalensimulationen.
Die Wissenschaftlerinnen und Wissenschaftler spürten vorübergehende Anionenbindungsstellen auf, erhielten Hinweise darauf, wie die Lichtenergie im Pumpmechanismus genutzt wird, und identifizierten sterische und elektrostatische molekulare Gates, die den unidirektionalen Transport gewährleisten. Sie stellten fest, dass eine Wechselwirkung mit dem π-Elektronensystem des Retinals die vorübergehende Bindung von Chloridionen über einen wichtigen Engpass im Transportweg unterstützt.
Basierend auf diesen Ergebnissen schlugen die Autoren wichtige mechanistische Merkmale vor, die einen präzise kontrollierten Chloridtransport durch die Zellmembran in einer solchen lichtbetriebenen Chloridionenpumpe möglich machen.
Publikation lesen
Über SFB 1078
Im Sonderforschungsbereich 1078 "Proteinfunktion durch Protonierungsdynamik" erforschen die Wissenschaftler und Wissenschaftlerinnen der Physik, Biologie und Chemie die grundlegende Rolle der Bewegung von Wasserstoffionen (Protonen) für die Funktion von Proteinen. Sprecher des SFB ist der Biophysik-Professor Dr. Joachim Heberle von der Freien Universität Berlin.
Schlagwörter
- AG Heberle
- Chloridtransport
- ETH Zürich
- Ionenpumpen
- Ladungstrennung
- lichtgetriebenen Chloridpumpe
- Proteine
- Proteinfunktion durch Protonierungsdynamik
- Publikation
- Science
- SFB 1078
- Umwandlung von Lichtenergie