Physikalisches Kolloquium: Dr. Sigrid Milles: Extrem dynamische Proteinsysteme - Integration von Einzelmolekül-Fluoreszenz und Kernspinresonanzspektroskopie
Dr. Sigrid Milles
Bildquelle: Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP)
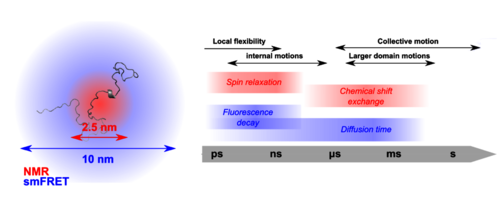
Förster-Resonanzenergietransfer
Bildquelle: Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP)
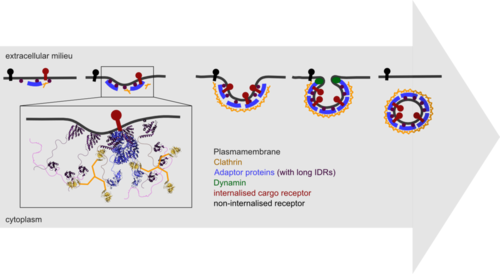
Endozytose
Bildquelle: Dr. Sigrid Milles
Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP), Fachbereich Strukturbiologie, Integrative Strukturdynamik, Berlin
Intrinsisch ungeordnete Proteine (IDPs) weisen keine klar definierte dreidimensionale Struktur auf und nehmen im Submikrosekundenbereich viele verschiedene Konformationen an. Diese extrem dynamischen Proteine sind hochflexibel und können sich leicht an verschiedene Bindungspartner anpassen, was sie zu wichtigen Akteuren in vielen biologischen Prozessen macht, oft mit lebenswichtigen regulatorischen Funktionen. Ihre dynamischen Eigenschaften und ihr breites Spektrum an Interaktionsmodi machen es jedoch schwierig, sie zu untersuchen, und die Analyse ihrer komplexen Strukturen erfordert oft integrierte Ansätze.
Meine Gruppe nutzt die komplementäre Natur und die Abstandsabhängigkeit der Kernmagnetischen Resonanz (NMR) und der Einzelmolekül-Fluoreszenz, insbesondere des Einzelmolekül-Förster-Resonanzenergietransfers (FRET), um die Konformationsstruktur und Dynamik von IDPs mit molekularer Auflösung zu untersuchen. Mit qualitativen und quantitativen Ansätzen werden Parameter aus beiden Techniken effektiv integriert, um ein neues Licht darauf zu werfen, wie IDPs und ihre Interaktionen mit gefalteten Proteinen verschiedene biologische Prozesse regulieren und ermöglichen.
Ein besonderer Schwerpunkt der Gruppe liegt auf dem Prozess der Clathrin-vermittelten Endozytose, dem wichtigsten zellulären Aufnahmeweg eukaryontischer Zellen, der während seiner Initiierungsphase ein komplexes Netzwerk von IDP-gesteuerten Interaktionen nutzt. Wir haben eine Fülle von Interaktionen unterschiedlicher Stärke und Dynamik aufgedeckt, von denen wir vermuten, dass sie für die Umgestaltung des Interaktionsnetzwerks verantwortlich sind, um schließlich zur Aufnahme eines Clathrin-beschichteten Vesikels zu führen.
Zeit & Ort
10.11.2023 | 15:00 c.t.
Hörsaal B (0.1.01)
Fachbereich Physik
Arnimallee 14
14195 Berlin
Weitere Informationen
Gastgeber
Schlagwörter
- Clathrin
- Clathrin-vermittelte Endozytose
- Einzelmolekül-Fluoreszenz
- Einzelmolekülfluoreszenz-Spektroskopie
- Förster-Resonanzenergietransfer
- FRET
- IDP
- IDR
- intrinsisch ungeordnete Polypeptidketten
- intrinsisch ungeordnete Regionen
- Kernmagnetische Resonanz
- lineare Motive
- NMR
- NMR-Spektroskopie
- Proteindynamik
- Proteine
- Sigrid Milles